
Podręcznik interpretacji wyników uzyskanych
za pomocą panelu VENTANA MMR RxDx
Panel przeznaczonego do oceny tkanek raka
trzonu macicy (endometrial carcinoma, EC)
VENTANA anti-MLH1 (M1) Mouse Monoclonal Primary Antibody
VENTANA anti-PMS2 (A16-4) Mouse Monoclonal Primary Antibody
VENTANA anti-MSH2 (G219-1129) Mouse Monoclonal Primary Antibody
VENTANA anti-MSH6 (SP93) Rabbit Monoclonal Primary Antibody


Spis treści
Wstęp 1
Przeznaczenie 3
Przeznaczenie produktu 3
Przeznaczenie tego podręcznika interpretacji 3
Ocena kliniczna 4
Charakterystyka barwienia 4
Kryteria dopuszczalności morfologii i wybarwienia tła 5
Kryteria, które musi spełniać przypadek przeznaczony do oceny klinicznej 5
Algorytm oceniania 6
Kontrole 8
Wewnętrzne kontrole dodatnie 8
Postępowanie z materiałem badanym 10
Zdjęcia referencyjne 12
Przypadki wskazujące na prawidłowe działanie systemu MMR 12
Przypadki wskazujące na upośledzenie działania systemu MMR 14
Trudne przypadki 18
Wpływ warunków przedanalitycznych na działanie panelu VENTANA MMR RxDx Panel 28
Dopuszczalne warunki utrwalania umożliwiające uzyskanie optymalnych wyników barwienia 28
Stabilność preparatów ciętych skrawków tkanek 32
Grubość tkanki 32
Bibliografia 33


Naprawa niesparowanych zasad w DNA (mismatch repair, MMR)
to konserwowany mechanizm molekularny, którego funkcją jest
korygowanie substytucji nieodpowiednich zasad, występujących
spontanicznie podczas replikacji DNA. Wyniki badań wykonywanych
metodami opartymi na łańcuchowej reakcji polimerazy (polymerase
chain reaction, PCR) wskazują, że nieprawidłowe działanie
systemu MMR często prowadzi do niestabilności mikrosatelitarnej
(microsatellite instability, MSI), zaburzenia, które powoduje insercję
krótkich, tandemowych powtórzeń nukleotydów do sekwencji
DNA.– Jeśli odsetek powtórzeń w badanym loci mikrosatelitarnym
wynosi co najmniej 30%, MSI jest określana jako niestabilność
mikrosatelitarna wysokiego stopnia, czyli MSI-High (MSI-H).
Zaburzenia działania systemu MMR powiązano z mutacjami
występującymi w białkach tworzących system MMR, najczęściej
w białkach MLH1, PMS2, MSH2 i MSH6.
W prawidłowym stanie białka MLH1 i PMS2 współdziałają w formie
kompleksu heterodimerycznego, podobnie jak białka MSH2 i MSH6.
Gdy system MMR działa prawidłowo, heterodimer złożony z białek
MSH6/MSH2 przyłącza się do sekwencji DNA, w której obecne są
niesparowane zasady. Wywołuje to zmianę konformacyjną, która
umożliwia związanie kompleksu MSH6/MSH2 z przyłączonym DNA
przez heterodimer MLH1/PMS2, co prowadzi do naprawy DNA
poprzez wycięcie odcinka DNA z niesparowanymi zasadami.
Mutacje lub niedobory tych białek przyczyniają się do częstego
występowania MSI i mutacji somatycznych w wyniku błędów
replikacji. Wykazano, że badania pod kątem systemu MMR metodami
immunohistochemicznymi (immunohistochemistry, IHC) mogą być
przydane do identyfikacji genów systemu MMR, w których mogą być
obecne mutacje germinalne lub somatyczne.
Zwykle schematy leczenia pacjentów z rakiem były zdeterminowane
przez specyficzny typ złośliwości. Nowe immunoterapie, zwłaszcza te,
które modyfikują szlaki komórkowe, w które zaangażowane są białka
takie jak receptor programowanej śmierci 1 (programmed death
1, PD-1) lub ligand programowanej śmierci 1 (programmed death
ligand 1, PD-L1), przyczyniają się jednak do wprowadzania zmian
w strategiach terapeutycznych stosowanych przez lekarzy. Białko
PD-1 to receptor hamujący, ulegający ekspresji w limfocytach T po
ich aktywacji, która utrzymuje się w stanach przewlekłej stymulacji,
takich jak przewlekłe zakażenie lub obecność raka. Ekspresję
białka PD-L1 wyryto w komórkach układu odpornościowego oraz
komórkach nowotworów złośliwych, a nieprawidłowa ekspresja
białka PD-L1 w komórkach nowotworowych (tumor cell, TC)
upośledza odpowiedź odpornościową skierowaną przeciwko
komórkom nowotworowym, awięc utrudnia możliwość ich
eliminacji. Z tego względu przerwanie szlaku PD-L1/PD-1
wydaje się być obiecująca strategią wzmocnienia odpowiedzi
odpornościowej limfocytów T skierowanej przeciwko tym komórkom.
Białka tworzące system MMR (MLH1, PMS2, MSH2 i MSH6)
ulegają ekspresji w proliferujących komórkach prawidłowych
i komórkach nowotworów złośliwych. W wielu powszechnie
występujących rakach stwierdzane jest upośledzenie działania
systemu MMR (MMR deficient, dMMR) oraz obecność MSI.
Liczne badania wskazują, że niedobór białek systemu MMR
jest skorelowany ze wzmożoną ekspresją białek PD-1 lub
PD-L1.– Białka systemu MMR mogą zatem służyć jako
biomarkery predykcyjne wskazujące możliwość wdrożenia
terapii ukierunkowanej na białko PD-1; na zwiększone
prawdopodobieństwo odpowiedzi na terapię tego typu może
wskazywać szczególnie utrata ekspresji co najmniej jednego
białka systemu MMR.– Stosowanie inhibitorów białka
PD-1 może być korzystne w przypadku wielu, powszechnie
występujących raków charakteryzujących się wysoką częstością
występowania upośledzenia działania systemu MMR i/lub
MSI-H, niezależnie od tkanki, z której wywodzi się rak.
Pacjenci, w przypadku których rozważane jest wdrożenie
terapii ukierunkowanej na białko PD-1, odniosą zatem
korzyści ze stosowania towarzyszącego testu diagnostycznego
umożliwiającego identyfikację populacji pacjentów, u których
występuje upośledzenie działania systemu MMR.
Rak trzonu macicy (endometrial carcinoma, EC) to jeden z
najczęściej występujących nowotworów złośliwych układu
rozrodczego.
12
W przypadku tego raka często stwierdzana jest
obecność wielu mutacji genetycznych, w tym MSI.
12
Sugerowane
jest również, że MSI obecne w rakach trzonu macicy mogą
powodować wzrost ekspresji białka PD-L1 w porównaniu do
raków trzonu macicy o genotypie stabilności mikrosatelitarnej
(microsatellite stability, MSS).
16
Metody leczenia raka trzonu
macicy różnią się w zależności od stopnia zaawansowania,
histologii oraz stadium choroby,
17
ocena statusu systemu MMR
raka trzonu macicy może jednak ułatwić prognozowanie oraz
dobór odpowiedniego schematu leczenia.
12
Pacjenci, w przypadku
których rozważane jest wdrożenie terapii ukierunkowanej
na białko PD-1, odniosą zatem korzyści z zastosowania
towarzyszącego testu diagnostycznego umożliwiającego
identyfikację statusu systemu MMR.
Utrata ekspresji któregokolwiek z kluczowych białek systemu
MMR, w tym białka MLH1, PMS2, MSH2 lub MSH6, prowadzi do
upośledzenia działania systemu MMR. Jeśli w guzie obserwowane
jest wybawienie wszystkich czterech markerów białkowych, status
VENTANA MMR IHC wskazuje na prawidłowe działanie systemu
MMR. Jeśli w guzie nie jest obserwowane wybarwienie co
najmniej jednego markera białkowego z panelu VENTANA MMR
RxDx Panel, status VENTANA MMR IHC wskazuje na upośledzenie
działania systemu MMR.
Wstęp
Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 1

2 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy

Przeznaczenie
Przeznaczenie produktu
Szczegółowe informacje dotyczące przeznaczenia tego produktu
oraz powiązane wskazania przedstawiono w odpowiednich
ulotkach dołączonych do opakowania panelu VENTANA MMR
RxDx Panel.
Przeznaczenie tego podręcznika interpre-
tacji
Ten podręcznik opracowano w celu:
• udostępnienia patomorfologom narzędzia ułatwiającego
ocenę kliniczną utrwalonych w formalinie i zatopionych
w parafinie (FFPE) skrawków tkanek guza wybarwionych
przy użyciu panelu VENTANA MMR RxDx Panel zgodnie z
proponowanymi zasadami znakowania przy użyciu produktu;
• udostępnienia obrazów fotograficznych ilustrujących wzory
barwienia, które można otrzymać po wybarwieniu tkanek
nowotworowych przy użyciu panelu VENTANA MMR RxDx
Panel;
• udostępnienia przykładowych obrazów trudnych przypadków
w celu przedstawienia wskazówek dotyczących ich oceny;
• udostępnienia wskazówek dotyczących korzystania z
elementów tkanek prawidłowych, dodatnich względem białek
systemu MMR, które służą jako wewnętrzna kontrola dodatnia
podczas przeprowadzania barwienia przy użyciu panelu
VENTANA MMR RxDx Panel.
Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 3

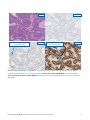
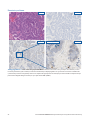
Status systemu MMR — niezakłócona ekspresja białek lub utrata ekspresji białek: w tych przypadkach raka trzonu
macicy obserwowane jest jednoznaczne wybarwienie jąder komórkowych — dominujący wzór barwienia obserwowany w większości
nowotworowych tkanek ze statusem: niezakłócona ekspresja białka MSH6 (panel po lewej). Brak barwienia jądrowego w
tkankach nowotworowych reprezentuje status: utrata ekspresji białka MSH6 (panel po prawej). Jednoznaczne barwienie jądrowe
w komórkach służących jako kontrola wewnętrzna (tj. limfocytach) w pobliżu żywotnych komórek nowotworowych jest wskaźnikiem
dopuszczalności wewnętrznych kontroli dodatnich.
Charakterystyka barwienia
Ocena kliniczna
Komórki wyznakowane w ramach każdego testu zawartego w panelu
VENTANA MMR RxDx Panel są oceniane pod kątem obecności
lub braku sygnału generowanego przez diaminobenzydynę
(diaminobenzidine, DAB). Białka systemu MMR wybarwione przy
użyciu panelu VENTANA MMR RxDx Panel wykazują jądrowy wzór
barwienia. Utrata ekspresji co najmniej jednego z białek systemu
MMR wykrywanych przez panel VENTANA MMR RxDx Panel jest
obserwowana w jądrach komórek nowotworowych. Status systemu
MMR, czyli niezakłócona ekspresja białek lub utrata ekspresji białek,
jest wyznaczany wyłącznie na podstawie jednoznacznego barwienia
jądrowego w komórkach.
• Status: niezakłócona ekspresja białek charakteryzuje
się występowaniem komórek nowotworowych, w których
obserwowane jest jednoznaczne wybarwienie o intensywności
równej lub większej od intensywności wybarwienia kontroli
wewnętrznych powyżej tła.
• Status: utrata ekspresji białek charakteryzuje się brakiem
wykrywalnych sygnałów. W przypadkach ze stwierdzoną
utratą ekspresji może być obserwowane jasnoszare
odbarwienie jąder komórkowych.
Sygnał może być rozłożony równomiernie i charakteryzować
się jednolitym poziomem intensywności w całej nowotworowej
części guza lub rozłożony nierównomiernie i charakteryzować się
zmiennym poziomem intensywności. Sygnał powinien być łatwo
wykrywalny przy małych powiększeniach, takich jak 2x lub 4x.
Przykładowe zdjęcia różnych typów komórek nowotworowych/
wybarwionych elementów wyznakowanych przy użyciu
panelu VENTANA MMR RxDx Panel przedstawiono w części
Zdjęcia referencyjne tego podręcznika interpretacji. W celu
oceny obecności wybarwienia tła w próbkach testowych oraz
oszacowania wyjściowej intensywności wybarwienia stosuje się
odczynnik do kontroli ujemnej (negative reagent control, NRC)
w postaci przeciwciała dopasowanego do gatunku. Kryteria
dopuszczalności morfologii i wybarwienia tła podano w Tabeli 1.
Kryteria, które musi spełniać przypadek przeznaczony do oceny
statusu systemu MMR tkanek nowotworowych przy użyciu
dowolnego z czterech testów zawartych w panelu VENTANA MMR
RxDx Panel, podano w Tabeli 2.
Brak barwienia jądrowego w
komórkach nowotworowych
Jednoznaczne barwienie jądrowe
w komórkach nowotworowych
Silne barwienie jądrowe
w limfocytach
4 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy
MSH6 10x MSH6 10x

Kryteria dopuszczalności morfologii i wybarwienia tła
Każdy przypadek wybarwiony przy użyciu panelu VENTANA MMR RxDx Panel jest oceniany pod kątem dopuszczalności morfologii
tkanek i wybarwienia tła na podstawie kryteriów opisanych w Tabeli 1.
Kryteria, które musi spełniać przypadek przeznaczony do oceny klinicznej
W Tabeli 2 podsumowano kryteria, które musi spełniać preparat z tkanką nowotworową przeznaczoną do oceny pod kątem statusu
systemu MMR, wybarwiony przy użyciu dowolnego testu zawartego w panelu VENTANA MMR RxDx Panel.
Kryterium Dopuszczalne Niedopuszczalne
Morfologia Istotne do oceny elementy komórkowe
są uwidocznione, co umożliwia kliniczną
interpretację swoistego wybarwienia
Istotne do oceny elementy komórkowe nie
są uwidocznione, co uniemożliwia kliniczną
interpretację swoistego wybarwienia
Tło Intensywność wybarwienia tła nie utrudnia
interpretacji klinicznej swoistego wybarwienia
Intensywność wybarwienia tła utrudnia interpretację
kliniczną swoistego wybarwienia
Tabela 1: Kryteria dopuszczalności morfologii i wybarwienia tła
Interpretacja kliniczna Kryteria dotyczące wzoru barwienia
Kryteria kwalifikujące przypadek do oceny
(wszystkie kryteria muszą być spełnione)
1. Obecność ≥50 żywotnych komórek nowotworowych w barwieniu H&E
2. Dopuszczalne wybarwienie preparatu wybarwionego przeciwciałem
Negative Reagent Control
3. Dopuszczalna morfologia
4. Dopuszczalne wybarwienie tła
5. Jednoznaczne barwienie jądrowe w komórkach służących jako
wewnętrzne kontrole dodatnie
Kryteria dyskwalifikujące przypadek
do oceny (jeśli którekolwiek kryterium
zostanie spełnione dla danego preparatu,
należy powtórzyć barwienie preparatu lub
odrzucić przypadek, odpowiednio do danej
sytuacji)
1. Obecność <50 żywotnych komórek nowotworowych w barwieniu H&E
2. Niedopuszczalne wybarwienie preparatu wybarwionego przeciwciałem
Negative Reagent Control
3. Niedopuszczalna morfologia
4. Niedopuszczalne wybarwienie tła
5. Niejednoznaczne barwienie jądrowe w komórkach służących jako
wewnętrzne kontrole dodatnie
6. Utrata tkanki, brak komórek nowotworowych, artefakty i/lub artefakty
brzegowe uniemożliwiające interpretację
Tabela 2: Kryteria kwalifikujące i dyskwalifikujące przypadek do oceny
Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 5

Panel VENTANA MMR RxDx Panel składa się z czterech
testów: VENTANA anti-MLH1 (M1) Mouse Monoclonal Primary
Antibody, VENTANA anti-PMS2 (A16-4) Mouse Monoclonal
Primary Antibody, VENTANA anti-MSH2 (G219-1129) Mouse
Monoclonal Primary Antibody i VENTANA anti-MSH6 (SP93)
Rabbit Monoclonal Primary Antibody. W celu wybarwienia tkanki
przy użyciu każdego z tych przeciwciał należy wykonać seryjne
skrawki tkanki badanej próbki; dodatkowe seryjne skrawki
tkanki badanej próbki potrzebne są do wybarwienia tkanki
hematoksyliną i eozyną (H&E) oraz przy użyciu przeciwciała NRC
odpowiadającego gatunkowi odpowiedniego przeciwciała panelu
VENTANA MMR RxDx Panel (Negative Control (Monoclonal)
(mNRC) lub Rabbit Monoclonal Negative Control Ig (rNRC)).
Komórki nowotworowe wybarwione za pomocą panelu VENTANA
MMR RxDx Panel są oceniane pod kątem obecności lub braku
sygnału DAB. Pochodzący z tej samej próbki preparat wybarwiony
przy użyciu przeciwciała NRC służy do oceny nieswoistego
wybarwienia tła oraz stopnia wybarwienia tła, które występuje
ze względu na obecność określonych elementów tkankowych
(patrz zdjęcia przypadków charakterystycznych dla prawidłowego
działania i upośledzenia działania systemu MMR).
Jeśli podczas oceny materiału pacjenta wybarwionego H&E
badacz stwierdzi, że materiał nie nadaje się do wybarwienia przy
użyciu panelu (na przykład obecnych jest mniej niż 50 żywotnych
komórek nowotworowych), konieczne będzie pobranie nowego
materiału.
Barwienie materiału przy użyciu określonego testu MMR
RxDx zawartego w panelu (np. VENTANA anti-MLH1 (M1)
Mouse Monoclonal Primary Antibody) należy powtórzyć przy
użyciu niewybarwionych preparatów, jeśli (1) dla preparatu
wybarwionego przy użyciu przeciwciała NRC odpowiedniego
dla danego testu nie uzyskano dopuszczalnego barwienia lub
(2) preparat wybarwiony przy użyciu określonego testu MMR
RxDx (np. VENTANA anti-MLH1 (M1) Mouse Monoclonal
Primary Antibody) nie kwalifikuje się do oceny. Jeśli interpretacja
któregokolwiek preparatu jest niemożliwa ze względu na brak
wybarwienia komórek służących jako wewnętrzne kontrole
dodatnie, obecność artefaktów, nekrozy, efektów brzegowych,
brak tkanki lub inne przyczyny, preparat nie kwalifikuje się do
oceny. Jeśli wybarwienie kontroli jest dopuszczalne, a preparaty
wybarwione przy użyciu panelu VENTANA MMR RxDx Panel
kwalifikują się do oceny, przeszkolony patomorfolog może
dokonać oceny preparatów w sposób opisany w algorytmie
oceniania.
UWAGA: Zestawy OptiView DAB IHC Detection Kit i OptiView
Amplification Kit to jedyne zestawy odczynników detekcyjnych
zalecane do użytku z panelem VENTANA MMR RxDx Panel.
W Tabelach 3 i 4 poniżej omówiono możliwe interpretacje
wybarwienia otrzymanego przy użyciu panelu VENTANA MMR
RxDx Panel pod kątem ekspresji białek i statusu systemu MMR.
Przypadki reprezentatywne omówiono w części Zdjęcia
referencyjne.
Ocena wybarwienia wykonanego przy użyciu panelu VENTANA MMR RxDx Panel:
Algorytm oceniania
Tabela 4: Interpretacja wybarwienia otrzymanego przy użyciu panelu VENTANA MMR RxDx Panel pod kątem statusu
systemu MMR
Prawidłowe działanie systemu MMR Upośledzenie działania systemu MMR
Niezakłócona ekspresja wszystkich czterech białek
(MLH1, PMS2, MSH2 i MSH6) identyfikowanych przez
panel
Utrata ekspresji co najmniej jednego z czterech białek (MLH1,
PMS2, MSH2 lub MSH6) identyfikowanych przez panel
Tabela 3: Interpretacja wybarwienia otrzymanego przy użyciu panelu VENTANA MMR RxDx Panel pod kątem ekspresji
białek
Niezakłócona ekspresja białek Utrata ekspresji białek
Jednoznaczne barwienie jądrowe w żywotnych
komórkach nowotworowych w obecności
dopuszczalnego wybarwienia wewnętrznych kontroli
dodatnich (np. barwienie jądrowe w limfocytach,
fibroblastach lub prawidłowych komórkach
nabłonkowych w pobliżu guza)
Jednoznaczny brak barwienia jądrowego w żywotnych
komórkach nowotworowych lub niejednoznaczne, ogniskowe,
słabe barwienie jądrowe w komórkach nowotworowych w
obecności dopuszczalnego wybarwienia wewnętrznych kontroli
dodatnich. Barwienie jądrowe o charakterze punktowym jest
uznawane za wybarwienie ujemne
6 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy

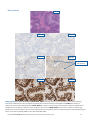
Rak trzonu macicy — diagnoza kliniczna: prawidłowe działanie systemu MMR
Status: niezakłócona ekspresja
białka MSH2: silne barwienie jądrowe w
obecności dopuszczalnego wybarwienia
wewnętrznych kontroli dodatnich
Status: niezakłócona ekspresja
białka PMS2: silne barwienie jądrowe w
obecności dopuszczalnego wybarwienia
wewnętrznych kontroli dodatnich
Status: niezakłócona ekspresja
białka MLH1: silne barwienie jądrowe w
obecności dopuszczalnego wybarwienia
wewnętrznych kontroli dodatnich
Rak trzonu macicy — diagnoza kliniczna: upośledzenie działania systemu MMR
Status: utrata ekspresji białka
MLH1: brak barwienia jądrowego w
obecności dopuszczalnego wybarwienia
wewnętrznych kontroli dodatnich
Status: utrata ekspresji białka
MSH6: brak barwienia jądrowego w
obecności dopuszczalnego wybarwienia
wewnętrznych kontroli dodatnich
Status: utrata ekspresji białka
MSH2: brak barwienia jądrowego w
obecności dopuszczalnego wybarwienia
wewnętrznych kontroli dodatnich
MLH1 20x MSH6 20x MSH2 20x
MSH2 20x
PMS2 20x
MLH1 20x
Jądra dodatnie
względem białka
MSH2
Jądra dodatnie
względem
białka PMS2
Jądra dodatnie
względem
białka MLH1
Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 7

Kontrole
Prawidłowe elementy tkankowe znajdujące się w pobliżu guza
w preparatach wybarwionych przy użyciu panelu VENTANA MMR
RxDx Panel, takie jak limfocyty, fibroblasty i prawidłowe komórki
nabłonkowe, wykazują barwienie jądrowe pod kątem białek
systemu MMR. Te elementy tkankowe służą jako wewnętrzne
kontrole dodatnie, a ich wybarwienie musi spełniać kryteria
dopuszczalności, aby można było zakwalifikować preparat
wybarwiony przy użyciu danego testu do oceny. Konieczne
jest dokonanie oceny wybarwienia kontroli wewnętrznych
dla każdego testu, a wybarwienie to musi spełniać kryteria
interpretacji pod kątem statusu systemu MMR określone
dla panelu. W przypadku braku jednoznacznego barwienia
jądrowego w limfocytach, fibroblastach lub prawidłowych
komórkach nabłonkowych w pobliżu guza preparat wybarwiony
przy użyciu testu należy uznać za „niekwalifikujący się do oceny”.
W Tabeli 5 przedstawiono kryteria dopuszczalności wybarwienia
kontroli wewnętrznych.
Kwalifikujący się do oceny Niekwalifikujący się do oceny
Obecność jednoznacznego barwienia jądrowego w
prawidłowych elementach tkankowych (np. limfocytach,
fibroblastach lub prawidłowych komórkach nabłonkowych)
w pobliżu guza
Brak jednoznacznego barwienia jądrowego w prawidłowych
elementach tkankowych (np. limfocytach, fibroblastach lub
prawidłowych komórkach nabłonkowych) w pobliżu guza
Tabela 5: Kryteria wybarwienia kontroli wewnętrznych
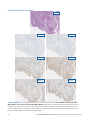
Wewnętrzna kontrola dodatnia — przypadek 1: brak wybarwienia kontroli wewnętrznej w pobliżu komórek nowotworowych
uniemożliwia ocenę przypadku raka trzonu macicy. Przedstawione dopuszczalne przeciwciało Negative Reagent Control to mysie
przeciwciało NRC (mNRC).
Wewnętrzne kontrole dodatnie
Poniżej znajdują się reprezentatywne zdjęcia przedstawiające kontrole wewnętrzne dla panelu VENTANA MMR RxDx Panel.
8 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy
H&E 40x mNRC 40x MLH1 40x

Wewnętrzna kontrola dodatnia — przypadek 2: silne wybarwienie komórki służącej jako kontrola wewnętrzna jest widoczne
w pobliżu komórek raka trzonu macicy na zdjęciu przypadku o statusie: utrata ekspresji białka MLH1 i na zdjęciu przypadku o
statusie: niezakłócona ekspresja białka MSH2. Dopuszczalnym przeciwciałem Negative Reagent Control jest mysie przeciwciało
NRC (mNRC).
MLH1 20x
Wybarwienie komórki służącej jako
kontrola wewnętrzna
Wybarwienie komórki służącej
jako kontrola wewnętrzna
Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 9
H&E 20x mNRC 20x
MSH2 20x

Postępowanie z materiałem badanym
Do wykonania testów przy użyciu panelu VENTANA MMR RxDx
Panel wymagane jest wykonanie kilku seryjnych skrawków tkanek
badanego materiału. Wymagane jest wykonanie po jednym
skrawku przeznaczonego do barwienia przy użyciu każdego z 4
testów: VENTANA anti-MLH1 (M1) Mouse Monoclonal Primary
Antibody, VENTANA anti-PMS2 (A16-4) Mouse Monoclonal
Primary Antibody, VENTANA anti-MSH2 (G219-1129) Mouse
Monoclonal Primary Antibody i VENTANA anti-MSH6 (SP93)
Rabbit Monoclonal Primary Antibody. Dodatkowo wymagane
jest wykonanie skrawków każdego materiału badanego
do wybarwienia H&E oraz przy użyciu przeciwciała NRC
odpowiadającego gatunkowi odpowiedniego przeciwciała panelu
VENTANA MMR RxDx Panel (mNRC lub rNRC).
Jeśli podczas oceny materiału pacjenta wybarwionego H&E
badacz stwierdzi, że materiał nie nadaje się do wybarwienia przy
użyciu panelu (na przykład obecnych jest mniej niż 50 żywotnych
komórek nowotworowych), konieczne będzie pobranie nowego
materiału. Barwienie materiału przy użyciu określonego testu
MMR RxDx zawartego w panelu (np. VENTANA anti-MLH1
(M1) Mouse Monoclonal Primary Antibody) należy powtórzyć
przy użyciu niewybarwionych preparatów, jeśli (1) dla preparatu
wybarwionego przy użyciu odpowiedniego odczynnika do kontroli
ujemnej nie uzyskano dopuszczalnego barwienia lub (2) preparat
wybarwiony przy użyciu określonego testu MMR RxDx (np.
VENTANA anti-MLH1 (M1) Mouse Monoclonal Primary Antibody)
nie kwalifikuje się do oceny. Jeśli interpretacja któregokolwiek
preparatu jest niemożliwa ze względu na brak wybarwienia
komórek służących jako wewnętrzne kontrole dodatnie, obecność
artefaktów, nekrozy, efektów brzegowych, brak tkanki lub inne
przyczyny, preparat nie kwalifikuje się do oceny. Jeśli kontrole
spełniają kryteria dopuszczalności, a preparaty wybarwione
przy użyciu panelu VENTANA MMR RxDx Panel kwalifikują się
do oceny, przeszkolony patomorfolog może dokonać oceny
preparatów w sposób opisany w algorytmie oceniania.
UWAGA: Zestawy OptiView DAB IHC Detection Kit i OptiView
Amplification Kit to jedyne zestawy odczynników detekcyjnych
zalecane do użytku z panelem VENTANA MMR RxDx Panel.
10 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy

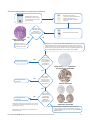
Schemat postępowania z materiałem badanym
Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 11
Skrawki o grubości 4 m są
osadzane na dodatnio naładowanych
szkiełkach (wymagane jest
przygotowanie 6 lub 7 skrawków
seryjnych)
Powtórzyć barwienie,
używając nowego materiału
pobranego od pacjenta*
Nie Tak
Czy preparat
wybarwiony H&E
spełnia kryteria
dopuszczalności (≥50
żywotnych komórek)?
W każdym teście zawartym w panelu VENTANA MMR RxDx Panel barwiony jest jeden
skrawek. Dodatkowo podczas każdego cyklu barwienia wykonywanego w aparacie
w każdych warunkach testu jeden skrawek barwiony jest przy użyciu odczynnika do
kontroli ujemnej w postaci przeciwciała dopasowanego do gatunku, Negative Control
(Monoclonal) (mNRC) lub Rabbit Monoclonal Negative Control Ig (rNRC).
Wynik MMR (MLH1, PMS2, MSH2, MSH6) jest ustalany
przez przeszkolonego patomorfologa zgodnie z algorytmem
oceniania wyników uzyskanych za pomocą panelu VENTANA
MMR RxDx Panel.
Nie
Nie
Nie
Tak
Tak
Tak
Czy preparat
wybarwiony przy
użyciu odczynnika
do kontroli ujemnej
spełnia kryteria
dopuszczalności?
Czy w każdym
wybarwionym
preparacie obecne
jest dopuszczalne
wybarwienie kontroli
wewnętrznych?
Czy preparaty
wybarwione przy
użyciu panelu
VENTANA MMR
RxDx Panel
spełniają kryteria
dopuszczalności?
Tkanka nowotworowa
wybarwiona H&E
Tkanka nowotworowa wybarwiona
przy użyciu przeciwciała NRC
*Powtórzenie można wykonać, korzystając z tego samego
bloczka lub innego bloczka tkanki tego samego pacjenta,
odpowiednio do sytuacji.
(Wszystkie zdjęcia tkanki nowotworowej wykonano przy
powiększeniu 20x)
Kontrola wewnętrzna
Tkanka nowotworowa
wybarwiona metodą IHC
Próbka tkanki nowotworowej
jest utrwalana w 10-procentowej
obojętnej buforowanej formalinie
przez 6–72 godzin.
Jeden skrawek jest barwiony H&E.
Powtórzyć cykl barwienia
Powtórzyć barwienie
przypadku*
Powtórzyć barwienie
przypadku*

12 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy
Zdjęcia referencyjne
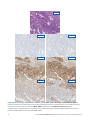
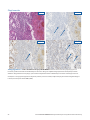
Przypadek nr 1 wskazujący na prawidłowe działanie systemu MMR: status: niezakłócona ekspresja białek MLH1, PMS2,
MSH2 i MSH6 w tkankach raka trzonu macicy wykazujących silne barwienie jądrowe w komórkach nowotworowych w obecności
dopuszczalnego wybarwienia kontroli wewnętrznych. Przedstawione dopuszczalne przeciwciała Negative Reagent Control to mysie
przeciwciało NRC (mNRC) i królicze przeciwciało NRC (rNRC).
Przypadki wskazujące
na prawidłowe działanie
systemu MMR
mNRC 20x
rNRC 20x
MLH1 20x PMS2 20x
MSH2 20x MSH6 20x
H&E 20x

Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 13
Przypadek nr 2 wskazujący na prawidłowe działanie systemu MMR: status: niezakłócona ekspresja białek MLH1, PMS2,
MSH2 i MSH6 w tkankach raka trzonu macicy wykazujących silne barwienie jądrowe w komórkach nowotworowych w obecności
dopuszczalnego wybarwienia kontroli wewnętrznych. Dopuszczalnymi przeciwciałami Negative Reagent Control są mysie przeciwciało
NRC (mNRC) i królicze przeciwciało NRC (rNRC).
H&E 20x
mNRC 20x rNRC 20x
MLH1 20x PMS2 20x
MSH2 20x MSH6 20x

14 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy
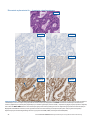
Przypadek nr 1 wskazujący na upośledzenie działania systemu MMR: status: utrata ekspresji białek MLH1 i PMS2
w tkankach raka trzonu macicy wykazujących brak barwienia jądrowego w komórkach nowotworowych w obecności dopuszczalnego
wybarwienia kontroli wewnętrznych. Dla białek MSH2 i MSH6 otrzymano status: niezakłócona ekspresja. Barwienie
cytoplazmatyczne jest pomijane podczas interpretacji statusu. Dopuszczalnymi przeciwciałami Negative Reagent Control są mysie
przeciwciało NRC (mNRC) i królicze przeciwciało NRC (rNRC).
Przypadki wskazujące na upośledzenie działania systemu MMR
H&E 20x
mNRC 20x rNRC 20x
MLH1 20x PMS2 20x
MSH2 20x MSH6 20x

Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy 15
Przypadek nr 2 wskazujący na upośledzenie działania systemu MMR: status: utrata ekspresji białek MLH1 i PMS2 w
tkankach raka trzonu macicy wykazujących brak barwienia jądrowego w komórkach nowotworowych w obecności dopuszczalnego
wybarwienia kontroli wewnętrznych. Dla białek MSH2 i MSH6 otrzymano status: niezakłócona ekspresja. Barwienie
cytoplazmatyczne jest pomijane podczas interpretacji statusu. Dopuszczalnymi przeciwciałami Negative Reagent Control są mysie
przeciwciało NRC (mNRC) i królicze przeciwciało NRC (rNRC).
H&E 20x
mNRC 20x rNRC 20x
MLH1 20x PMS2 20x
MSH2 20x MSH6 20x

16 Panel VENTANA MMR RxDx Panel przeznaczony do oceny tkanek raka trzonu macicy
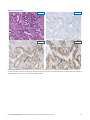
Przypadek nr 3 wskazujący na upośledzenie działania systemu MMR: status: utrata ekspresji białek MSH2 i MSH6 w
tkankach raka trzonu macicy wykazujących brak barwienia jądrowego w komórkach nowotworowych w obecności dopuszczalnego
wybarwienia kontroli wewnętrznych. Dla białek MLH1 i PMS2 otrzymano status: niezakłócona ekspresja. Barwienie
cytoplazmatyczne jest pomijane podczas interpretacji statusu. Dopuszczalnymi przeciwciałami Negative Reagent Control są mysie
przeciwciało NRC (mNRC) i królicze przeciwciało NRC (rNRC).
H&E 20x
mNRC 20x rNRC 20x
MLH1 20x PMS2 20x
MSH2 20x MSH6 20x
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
Strona się ładuje...
-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
 13
13
-
 14
14
-
 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
 20
20
-
 21
21
-
 22
22
-
 23
23
-
 24
24
-
 25
25
-
 26
26
-
 27
27
-
 28
28
-
 29
29
-
 30
30
-
 31
31
-
 32
32
-
 33
33
-
 34
34
-
 35
35
-
 36
36
-
 37
37
-
 38
38
Roche BenchMark ULTRA Interpretation Guide
- Typ
- Interpretation Guide
- Niniejsza instrukcja jest również odpowiednia dla
Powiązane artykuły
Inne dokumenty
-
 Hologic ThinPrep Stain EA Solution Instrukcja obsługi
Hologic ThinPrep Stain EA Solution Instrukcja obsługi
-
 Hologic ThinPrep Stain Bluing II Solution Instrukcja obsługi
Hologic ThinPrep Stain Bluing II Solution Instrukcja obsługi
-
 Hologic ThinPrep Stain Bluing Solution Instrukcja obsługi
Hologic ThinPrep Stain Bluing Solution Instrukcja obsługi
-
Gima 29927 Instrukcja obsługi
-
 Hologic ThinPrep Stain Rinse Solution Instrukcja obsługi
Hologic ThinPrep Stain Rinse Solution Instrukcja obsługi
-
 Hologic ThinPrep Stain Orange G Solution Instrukcja obsługi
Hologic ThinPrep Stain Orange G Solution Instrukcja obsługi










































